RS2E sous-action 2.1.1
Axe 2 : Fonctionnement biogéochimique de l'estuaire de la Loire

Action 2.1 Fonctionnement biogéochimique des vasières Edouard Metzger
sous-action 2.1.1 Cartographie hyperspectrale Vona Méléder-Tard
<< RS2E Axe 2
Problématique
Le microphytobenthos représente une part significative dans l'alimentation de la méiofaune et la macrofaune (Blanchard, 1991; Golfinch et Carman, 2000), des oiseaux limicoles tels l'avocette élégante (Kuwae et al., 2008), des poissons juvéniles et des crustacés ayant une valeur commerciale élevée mais également des suspensivores (Decottignies et al., 2007). Ainsi une destruction de son habitat induirait une perturbation de la chaine alimentaire de l'écosystème estuarien (Kuwae et al., 2008).
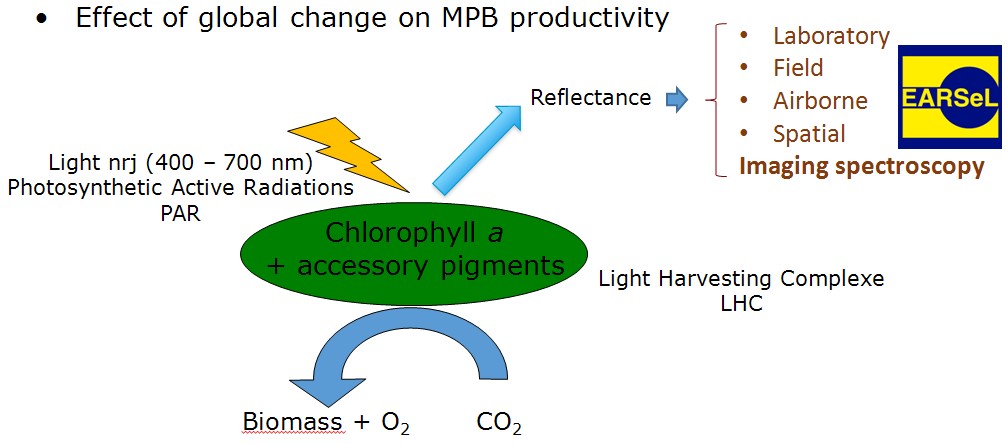
Figure 1 Bilan d'activité de la photosynthèse
Ce microphtytobenthos peut également être un marqueur sensible du changement climatique global. L'énergie solaire reçue est absorbée par la chlorophylle a et d'autres pigments accessoires pour être transformée en matière organique par fixation du CO2. Cette activité photosynthétique est peut-être indirectement déduite de l'observation de la lumière réfléchie vers une plateforme d'observation. L'identification des pigments ne peut être réalisée que par Imaging spectroscopy selon la nomenclature européenne d'EARSeL ou télédétection hyperspectrale (160 canaux au lieu de 3 à 5 en multispectral).
Méthode applications et résultats
Cette action a bénéficié du service d'observation hyperspectrale du littoral atlantique (SOHLA) de l'OSUNA qui est un programme de GEOPAL réunissant Pays de la Loire, Etat et FEDER, chargé de suivre sur une longue période l'évolution de différents marqueurs de la qualité de l'environnement en Pays de la Loire. Il s'agit ici des biofilms de microalgues des vasières de l'estuaire constituant le microphytobenthos observables à marée basse par télédétection hyperspectrale. Sa quantification à distance a fait l'objet d'un développement méthodologique conséquent [1 à 9] et d'un suivi régulier de 2002 à 2013 (2010 à 2013 dans le cas de l'estuaire). Le choix de la spectrométrie à haute résolution spectrale (hyperpsectrale) est hérité de l'expérience en planétologie du LPG et se justifie par la capacité de cette haute résolution à individualiser la présence des chlorophylles a, b et c, et celle des pigments accessoires, permettant d'aborder la physiologie des organismes, de distinguer les principales classes des espèces constituant les biofilms et de faire des cartographies synoptiques et quantitatives à toute échelle. Les capteurs choisis peuvent ainsi opérer aussi bien à partir d'un avion que sur le terrain et en laboratoire de façon à maîtriser toute la chaîne des transformations du signal spectral depuis la tâche centimétrique du biofilm des vasières ou des cultures de laboratoire jusqu'à celle de plusieurs pixels d'une image aérienne. Cette expérimentation en laboratoire effectuée par MMS a permis de développer le premier modèle de transfert radiatif du biofilm microphytobenthique, le MPBOM [6]. Associé à l'utilisation d'indices spécifiques afin de discriminer micro et macro-algues sur la vasière, et au sein même du biofilm Euglènes et Diatomées [5 et 7], ce modèle a été appliqué avec succès aux images de SOHLA.
Les résultats de cette cartographie reposent dans le cas de l'estuaire sur une partie de la thèse d'Ismail Benyoucef (2010-2014). L'objectif de cette sous-action est de cartographier les producteurs primaires, majoritairement constitués de micro-algues benthiques, le microphytobenthos, colonisant les vasières intertidales de l'estuaire de la Loire. Cette cartographie repose sur l'expertise conjointe du LPGN et de MMS, alliant le traitement des images hyperspectrales et les campagnes de terrain. Plus précisément, la méthodologie utilisée permet d'évaluer à partir d'échantillonnages de terrain, les variations de la biomasse, de la composition pigmentaire et de la diversité spécifique du microphytobenthos et d'autre part, de déterminer les structures spatio-temporelles du biofilm qu'il constitue à macro et méso-échelle par télédétection hyperspectrale, validée par les observations de terrain.
Figure 2 : Localisation de la zone d'étude
Campagnes de terrain.
Les campagnes de terrain ont été réalisées durant 12 mois, entre janvier 2011 et janvier 2012, sur 4 vasières des secteurs poly- et mésohalin (Figure 3). Trois se situent dans le domaine polyhalin: la vasière de Méan; la vasière de l'Imperlay et la vasière des Brillantes. Cette dernière est la plus large vasière de l'estuaire. Dans le domaine mésohalin, seule la vasière de Lavau, se trouvant en aval de la centrale thermique de Cordemais, a été étudiée. Pour chaque vasière, trois stations ont été échantillonnées (Figure 2) le long d'une radiale, chaque point de prélèvement a été positionné en fonction de la bathymétrie, entre +4 et +3 m (au-dessus du zéro des cartes marines) pour la station 1, entre +3 et +2 m pour la station 2 et entre +2 et +1 m pour la station 3. Les stations du haut et de milieu estran de la vasière des Brillantes (Br1 et Br2) correspondent respectivement aux stations S1 et S2 des sous-actions 2.1.2 et 2.1.3.
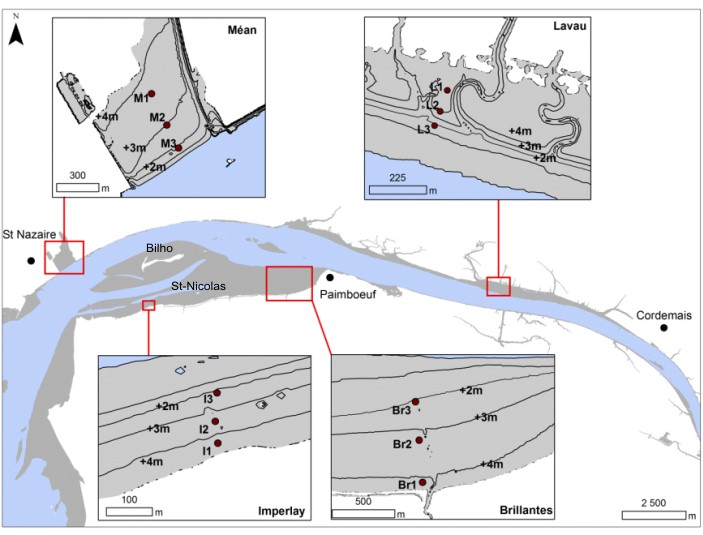
Figure 3 Localisation des vasières et des stations échantillonnées dans les deux domaines halins de l'estuaire de la Loire. Polyhalin : M: Méan, I : Imperlay, Br: Brillantes. Mesohalin : L: Lavau. Les stations Br1 et Br2 correspondent respectivement aux stations S1 et S2 des sous-actions 2.1.2 et 2.1.3.
Les prélèvements ont été effectués tous les deux mois pendant l'hiver et le début du printemps et chaque mois pendant l'été et le début de l'automne, lors des marées basses présentant les plus forts coefficients de marée (> 80). Le prélèvement de sédiment et du microphytobenthos associé a été réalisé par la méthode de contact-core (Honeywill et al., 2002). Ce dispositif permet de congeler et prélever les 2 premiers millimètres de sédiment. Pour chaque station, 9 réplicats ont été prélevés puis conservés au -80°C pour l'analyse pigmentaire par Chromatographie Liquide Haute Performance (HPLC) pour réduire la variabilité spatiale à micro-échelle (Spilmont et al., 2011). Deux autres prélèvements ont été effectués, puis conservés au -20°C, un pour l'analyse granulométrique et un autre pour l'analyse taxonomique.
Les résultats des analyses pigmentaires par HPLC montrent que les pigments détectés, en plus de la chlorophylle a (Chl a), correspondent aux principaux pigments caractérisant les diatomées: la chlorophylle c, la fucoxanthine et la diadinoxanthine et la diatoxanthine. En revanche l'absence de chlorophylle b et de zéaxanthine s'expliquerait par une absence d'euglènes et/ou de chlorophycées et de cyanophycées.
La quantification de la Chl a en mg.m-2 permet d'estimer la biomasse microphytobenthique colonisant les vasières. Quelles que soient les stations et la saison, les biomasses présentent une variabilité significative (ANOVA 2 facteurs P<0.001). Les plus faibles concentrations en Chl a sont obtenues sur la vasière de Méan avec une moyenne annuelle de 27,0±2,0 mg Chl a.m-2 (moyenne ± IC95%) suivi de Brillantes avec 29,6±3.2 mg.m-2 et de l'Imperlay avec 39,5±3,5 mg.m-2. Ces concentrations sont inférieures à celles mesurées sur la vasière de Lavau qui se caractérise par une biomasse annuelle de 59,5±3,4 mg.m-2 (ANOVA, P<0,01). D'une façon générale, les biomasses les plus élevées se trouvent en haut d'estran et les plus faibles en bas des vasières. Les valeurs mensuelles de Chl a moyennées à l'ensemble des vasières ont permis d'estimer une tendance générale de la variabilité temporelle à l'échelle de l'estuaire de la Loire : un cycle saisonnier du microphytobenthos (R2=0,91, P<0,05), avec des concentrations minimales en hiver et maximales atteinte en été. Cette tendance est similaire à celle observée dans d'autres estuaires nord européens caractérisés par des blooms printaniers et estivaux (e.g. van der Wal et al., 2010).
Les résultats de granulométrie montrent que les sédiments sont constitués d'argiles, de silts, de sables très fins à très grossiers. Les argiles ne dépassent jamais 9% alors que les silts peuvent représenter jusqu'à 98% de la fraction vaseuse. La fraction sableuse est principalement constituée de sables très fin à fin, sauf sur la vasière des Brillantes où la station Br3 est caractérisée par des sables moyens à grossiers (jusqu'à 75% de la fraction sableuse). Sur les 4 vasières échantillonnées, les stations les plus vaseuses se situent en haut d'estran et les plus sableuses en bas d'estran.
Enfin, 90 taxa de diatomées ont été identifié. Les assemblages sont dominés par 6 espèces epipéliques: Navicula phyllepta, Navicula gregaria, Navicula spartinetensis, Navicula phylleptosoma, Cylindrotheca gracilis and et Gyrosigma fasciola, présentant un cycle saisonnier. Les vasières du domaine polyhalin présentent les plus fortes richesses spécifiques, alors que celle du domaine mésohalin (Lavau) a une richesse plus faible, mais associée aux plus fortes biomasses. De petites espèces centriques pélagiques, comme Thalassiosira, sont régulièrement observées en proportion importante sur toutes les stations. Leur présence serait le résultat de processus de déposition de particules en suspension à la surface des vasières. La granulométrie est le facteur expliquant le plus la variabilité spécifique. Les stations vaseuses, comme celles de Lavau, sont colonisées toute l'année par des espèces épipéliques, alors que les stations ayant une proportion en sable augmentant à certaines périodes de l'année, sont alors colonisées par des espèces épipsammiques, comme la station 2 des Brillantes.
Cartogaphie du microphytobenthos à macro-échelle par télédétection hyperspectrale.
Bien qu'essentiels à la connaissance du microphytobenthos des vasières intertidales, esturariennes en particulier, les campagnes de terrain ne permettent pas d'appréhender la structure de ces peuplements à macro-échelle. Seule la télédétection offre une vision synoptique pouvant aboutir à la cartographie de la biomasse exprimée en mg Chl a.m-2 et ainsi de combler les vides laissés par les études in situ. La technologie hyperspectrale est nécessaire à l'extraction d'une information quantitative nécessitant l'emploi de bandes étroites seules capables de détecter les absorptions les plus fines, caractéristiques du microphytobenthos. La haute résolution spatiale est également nécessaire pour limiter le nombre de mélanges d'informations à l'échelle du pixel.
Les images ont été acquises grâce à la caméra hyperspectrale HySpex dont dispose le laboratoire de Planétologie et de Géodynamique de Nantes Université depuis 2008. Cette caméra mesure les radiances dans 160 bandes spectrales entre 400 et 1000 nm à une résolution spectrale de 4,5 nm et un pas d'échantillonnage spectral de 3,7 nm. Les campagnes aéroportées ont été réalisées le 11 septembre 2010, le 30 août 2011, le 22 septembre en 2013 et couvraient tout le domaine polyhalin de l'estuaire de la Loire. Lors de l'acquisition l'avion volait à une altitude de 2600 m, définissant un pixel de 1 x 1 m au sol. La ligne de vol de direction nord/sud était opposée au soleil, limitant les effets de « hot spot » sur l'image. En 2010, la campagne aéroportée a été effectuée avec une couverture nuageuse importante, ce qui s'est traduit par des lignes d'images plus sombres, le temps de survol a également été plus long. Les acquisitions de 2011 et 2013 ont été faites avec un temps clair et un temps de survol de 2 heures.

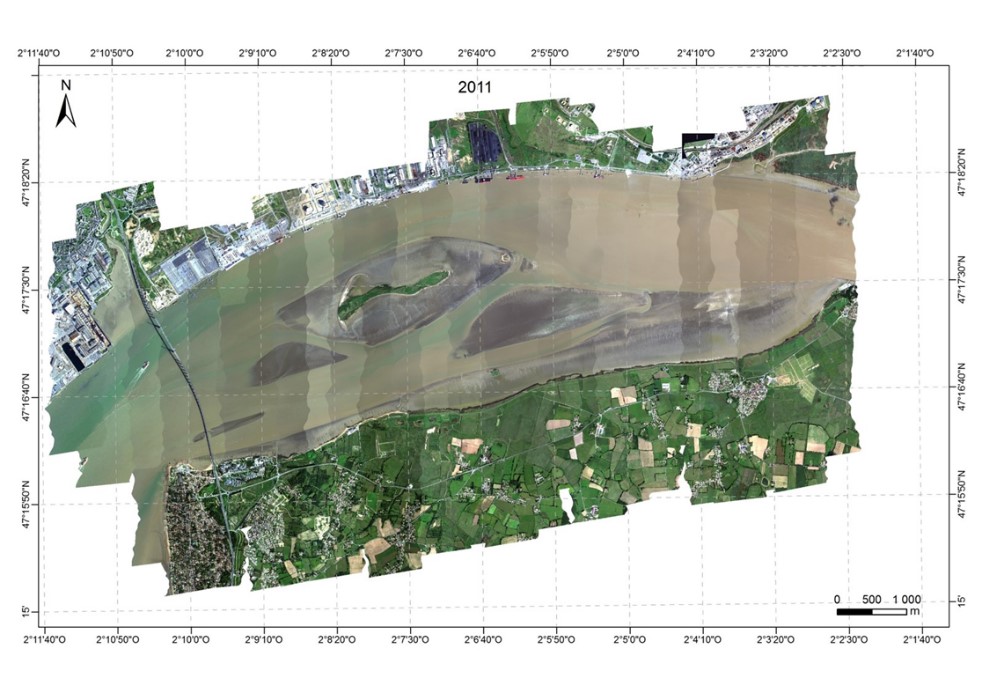
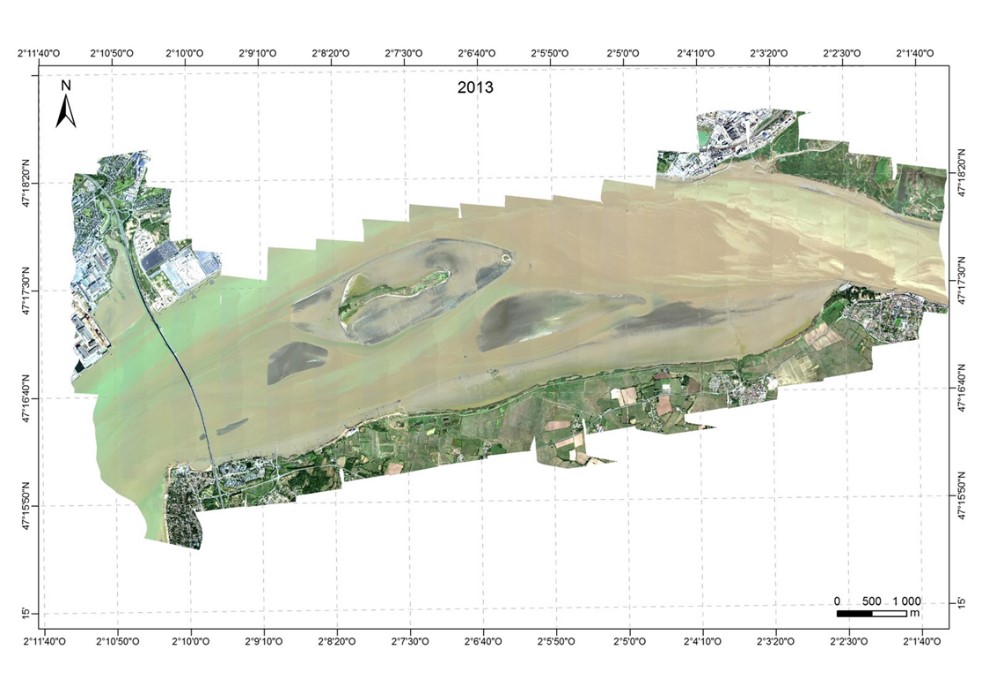
Figure 4 Composition colorée (associée aux canaux à 440, 550 et 638 nm) des images HySpex acquises en septembre 2010, août 2011 et septembre 2013, couvrant tout le domaine polyhalin de l'estuaire de la Loire.
La méthodologie utilisée est celle mise au point sur des vasières littorales (Combe et al 2005, Meleder et al. 2010, Kazemipour et al. 2011, 2012) et appliquée aux vasières de l'estuaire de la Loire. Dans un premier temps, les corrections atmosphériques ont été réalisées par l'utilisation du modèle de correction atmosphérique FLAASH (Fast Line-of-sight Atmospheric Analysis of Spectral Hypercubes), développé par l'Air Force Phillips Laboratory. Si la correction atmosphérique permet de retrouver la forme des spectres de réflectance, la détermination de leur intensité effective nécessite une correction complémentaire d'ajustement du gain entre les spectres de l'image et ceux d'un site de contrôle au sol. Cet ajustement est réalisé à partir de spectres de terrains acquis simultanément lors des campagnes aéroportées. Une fois les images transformées en réflectances, une série d'indices de végétation a été utilisée (Figure 5) : le NDVI afin d'éliminer les pixels non végétalisés puis le MPBI afin de ne retenir que ceux correspondant au microphytobenthos. En sont extraits ceux dominés par les diatomées par rapport à ceux dominés par les euglènes, à l'aide d'indices spécifiques, IDiatom et IEuglena.
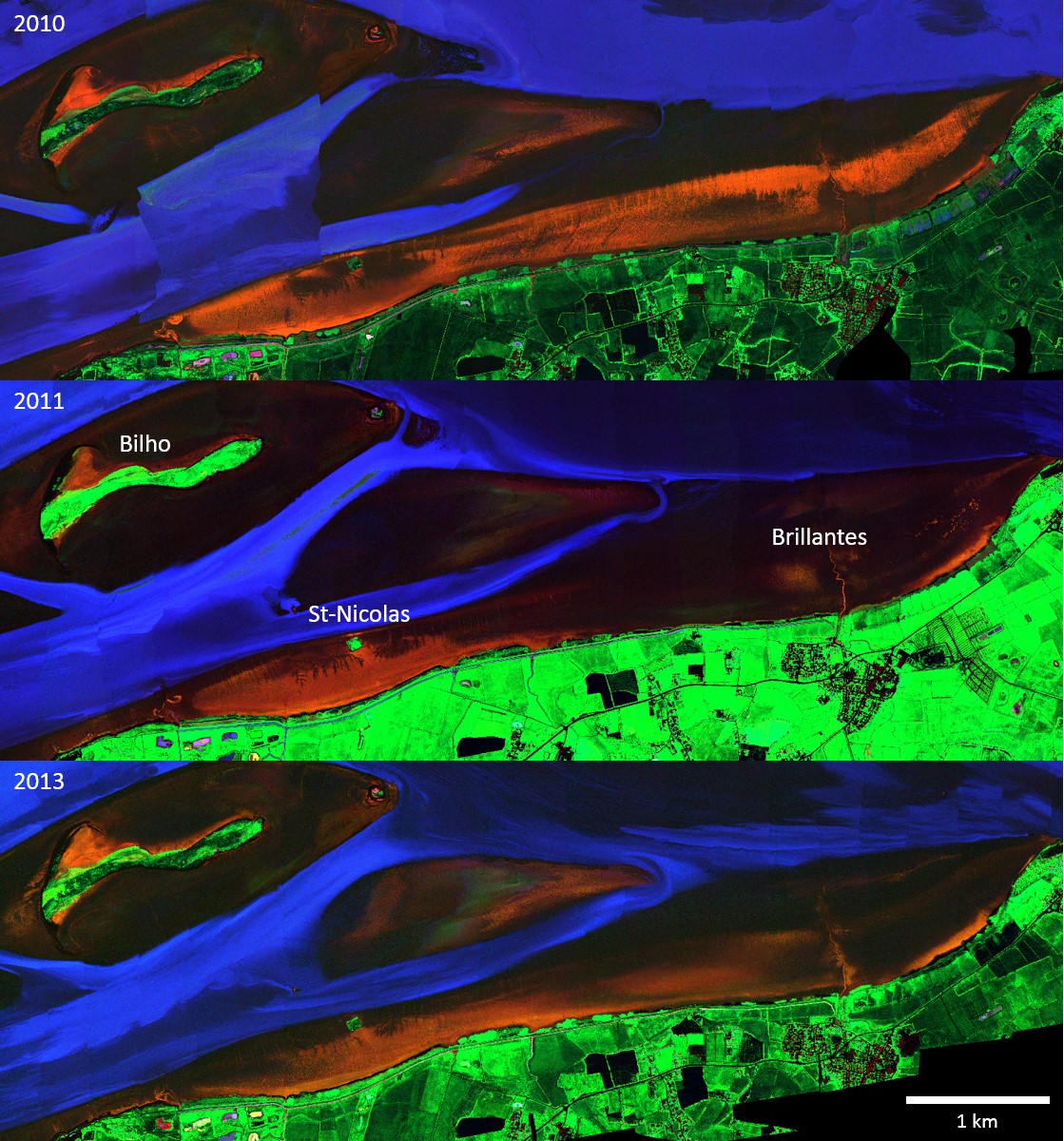
Figure 5 Composition colorée d'indices Diatomées( IDiatom) canal rouge, Microalgues vertes (IEuglen) canal vert et Eau claire superficielle canal bleu, de la zone d'intérêt principale entre Bilho et Brillantes montrant en orange les diatomées et en vert de euglens ou autres micro-algues vertes sur les vasières. D'après Kazemipour et al. 2012.
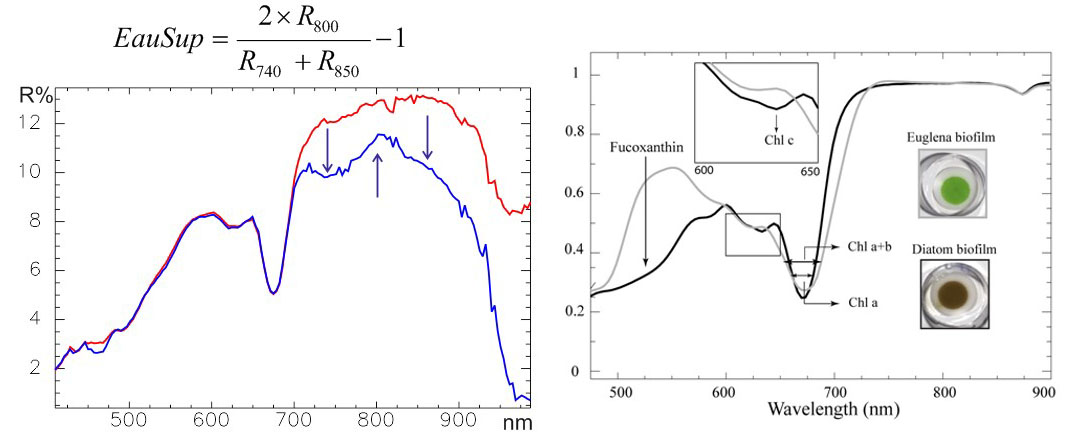
L'indice « EauSup » (Figure 6) permet de détecter les pellicules d'eau claire se formant à la surface des vasières et perturbant le modèle MPBOM. Les pixels recouverts de cette fine pellicule d'eau présentant un plateau infrarouge négatif (en bleu Figure 6) sont éliminés du traitement. Inversement la vase cohésive au sol ou en suspension mais concentrée apparait en noir sur la composition colorée de la Figure 5. On peut donc constater que les deux images à faible biomasse visible sur les Brillantes correspondent à deux dates de 2011 et 2013 à forte remobilisation de sédiments susceptible de recouvrir les Brillantes alors que l'image de 2010 à forte biomasse s'accompagne d'une eau claire au nord des brillantes.
a b
Figure 6 a) Indice Eau claire superficielle (différente de l'eau du sédiment), b) réflectances normées aux plateaux infrarouges réalisées en laboratoire (Kazemipour et al 2012) permettant de différencier diatomées à chlorophylle c (IDiatom)et euglens à chlorophylle b (IEuglena)
Cette anomalie de forte concentration au nord des brillantes s'observerait par forts courants et résulterait d'une remise en suspension très active. Il conviendrait de poursuivre ces observations pour conclure sur le lien entre dynamique du fleuve et couverture de la vasière des brillantes par un biofilm. Par contraste, les zones abritées à la côte marine de 4m du banc de Bilho et de l'ile Saint-Nicolas sont relativement stables dans le temps.
Cette interprétation rejoint les conclusions de l'action 2.1.2 qui montre que le mois de septembre est caractérisé par une érosion maximum des vases déposées pendant les crues d'hivers. La différence entre 2010 et les deux autres années pourrait s'expliquer simplement par un retard de cette érosion ou de conditions climatiques favorables qu'il reste aussi à vérifier à l'occasion de la période de valorisation de RS2E-OSUNA qui à pour but également de croiser les actions et sous actions entre elles.
Enfin, le modèle de transfert radiatif spécifique aux diatomées, le MPBOM (Kazemipour et al. 2012) a été appliqué aux pixels dominés par les diatomées afin d'obtenir des cartes de biomasses en mg de chlorophylle a. m-2 (Figure 7).
Les valeurs maximales estimées de chlorophylle a sont de 26 mg.m-2 en 2010 et 20 mg.m-2 en 2011 et 2013. Sur ces images, le microphytobenthos forme des structures longitudinales parallèles au rivage. Les peuplements microphytobenthiques apparaissent localisés sur la vasière des Brillantes en milieu et haut d'estran entre +3 et +5 m (Figure 7).
En 2011 et 2013, le biofilm présente de plus faibles biomasses localisées en haut d'estran entre +5 et +4m (zone abritée des forts courants ?) mais quelques taches microphytobenthique subsistent au milieu de la vasière des Brillantes avec une biomasse moyenne de 1,9 ± 1,1 mg.m-2, contre 4,1 ± 2,46 mg.m-2 en 2010 sur le même site (Figure 4 haut). Cette zone, suivie durant la période d'échantillonnage correspondait à cette époque à des assemblages dominés par des espèces épipsammiques ne formant pas de véritables biofilms. Dans les trois cas, Les zones à forte biomasse microphytobenthique se situent préférentiellement le long des chenaux ainsi qu'à l'embouchure des étiers en haut d'estran.
Le maximum d'extension de 2010 correspond aux observations faites sur la baie de Bourgneuf (Kazemipour et al 2012) dans lesquelles on constate également un développement de microphytobenthos à diatomée sur une bande allongée sur la côte maritime de +2 m à +3 m.
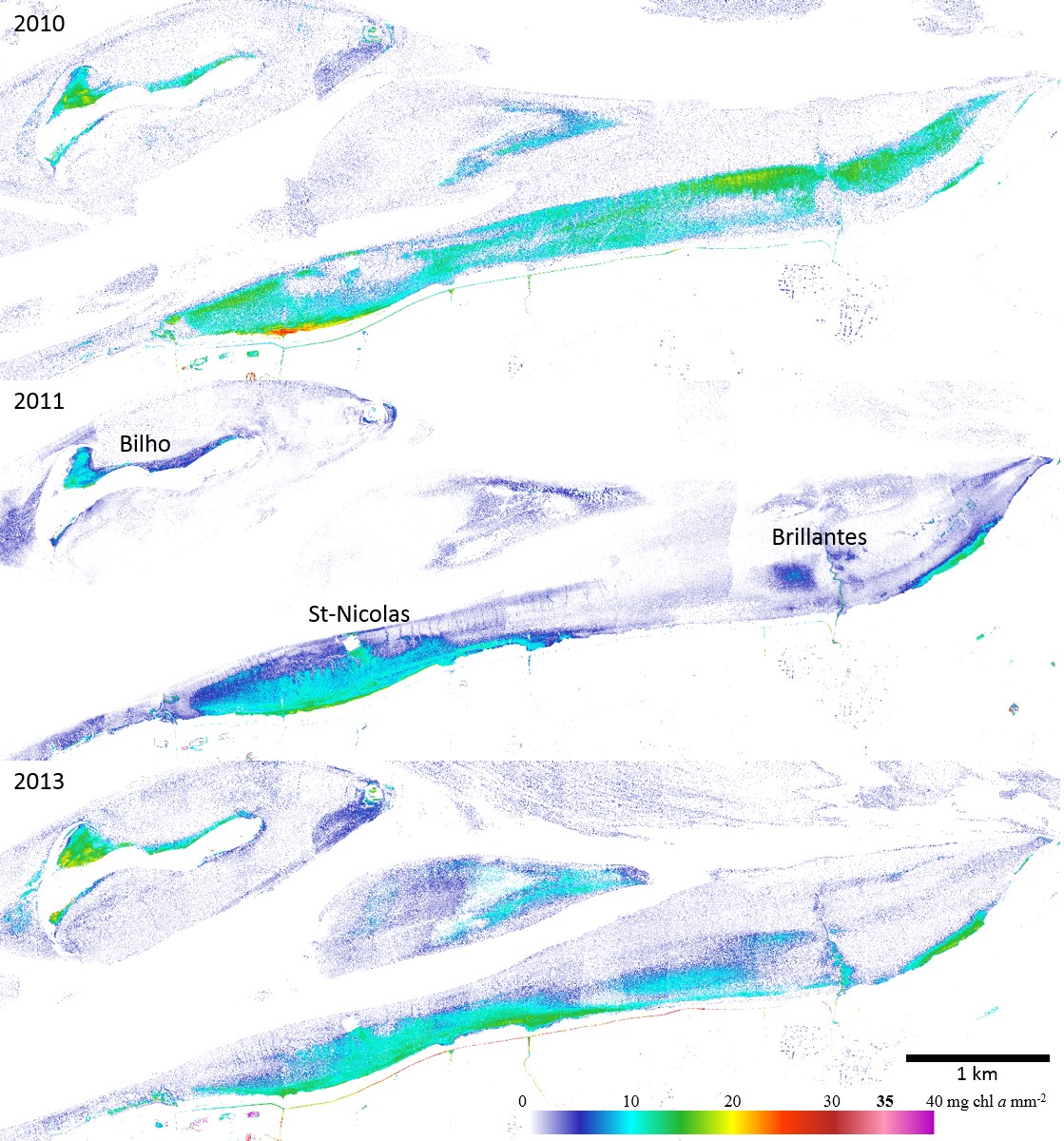
Figure 7 Cartographie de la biomasse (mg Chl a.m-2)de diatomées sur les vasières du domaine polyhalin de l'estuaire de Loire,après application du modèle MPBOM sur les images HySpex de 2010, 2011 et2013 (de haut en bas).
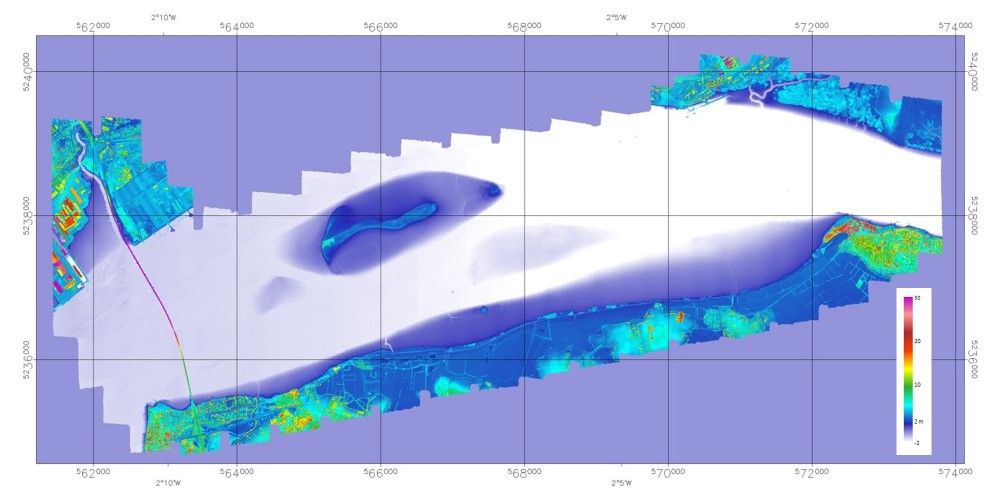
Figure 8 Cartographie LiDAR (ALS 70 FIT-Conseil) topographique conjointeà l'image hyperspectral de 2013
Cette Figure 8 de la couverture LiDAR acquise à partir de lamême plateforme aéroportée en septembre 2013 permet de vérifier également queles deux zones abritées correspondent en fait aux plus hauts fonds, les moinssoumis aux effets de courants.

Figure 9 Composition colorée des indices desélection des diatomées (voir Figure 5) de la zone d'intérêt de 2013 drapée surle modèle d élévation LiDAR exagérée 50 fois, entre Bilho et Brillante,en regardant vers l'est.
Cartographie dumicrophytobenthos à méso-échelle par télédétection hyperspectrale.

Figure 10 Images HySpex acquises in situ pour la cartographie du microphytobenthos àméso-échelle. En haut, image en réflectance obtenue à l'étale de marée basse(composition colorée associée auxcanaux à 440, 550 et 638 nm), au milieu, l'image des indices de sélection, enbas, image obtenue à l'étale de marée basse en biomasse mg chl a de diatomées.
Pour étudier l'effet du changement d'échelle, la caméraHySpex du LPG a été déployée sur le terrain (en Baie de Bourgneuf). Cettecampagne a eu lieu le 27 mai 2013, lors d'une marée basse à 13h21 et uncoefficient de marée de 104. 35 images ont été acquises, entre 10h00 et 15h30afin de suivre la formation du biofilm en taches. Chaque image est prise à lamême station, d'une taille de 1600 x 8855 pixels (Figure 10). En même temps queces acquisitions, le biofilm est échantillonné à proximité de la station pourdes analyses pigmentaires, taxonomique et granulométrique, ainsi que le dosagede la biomasse.
On peut constater que quelle que soit l'échelled'observation, la répartition des tâches plus ou moins grandes est similaired'une échelle à l'autre (comparer figure 10 et plages ouest de Bilho faisantface à l'observateur comme la Coupelasse). Cette particularité fait l'objet dedéveloppements méthodologiques toujours en cours de réalisation.
Bibliographie
[1] Méléder V. , Barillé L., LauneauP., Carrère V. et Rincé Y. (2003) "Spectrometric constraint inanalysis of benthic diatom biomass using monospecific cultures" RemoteSensing of Environment, 88, 386-400
[2] Méléder V., Launeau P., Barillé L. etRincé Y. (2003) "Cartographie despeuplements du microphytobenthos par télédétection spatiale visible-infrarougedans un écosystème conchylicole" Comptes Rendus Biologie Académies desSciences, Paris, 326, 377-389
[3] Combe, J., Launeau, P., Carrere, V., Despan, D.,Meleder, V., Barille, L., Sotin, C., (2005), Mapping microphytobenthos biomassby non-linear inversion of visible-infrared hyperspectral images, RemoteSensing of Environment, 98, (4), 371-387.
[4] Barillé, L., V. Méléder, J-P. Combe, P. Launeau, Y. Rincé, V. Carrère, M.Morançais (2007) "Comparative analysis of field and laboratory spectralreflectances of benthic diatoms with a modified Gaussian model approach" Journalof Experimental Marine Biology and Ecology, 343, (2), 197-209
[5] Méléder V., Launeau P., Barillé L., Combe J.-Ph.,Carrère V., Jesus B., Verpoorter Ch. (2010). Hyperspectral imaging for mappingmicrophytobenthis in coastal areas. In : Geomatic Solutions For CoastalEnvironments, Eds Maanan M. and Robin M. Nova Science Publishers, Inc. pp.71-139
[6] Kazemipour F.,V. Méléder, P. Launeau (2011) Optical properties of microphytobenthic biofilms(MPBOM): Biomass retrieval implication. Journal of Quantitative Spectroscopyand Radiative Transfer, Volume 112, Issue 1, January 2011, Pages 131-142
[7] Kazemipour, F., (2011) Caractérisation hyperspectraledes biofilms microphytobenthiques : Cartographie de la biomasse de la micro àla macro échelle. Thèse de Doctorat de Nantes Université. 198 p.
[8] Kazemipour, F., P. Launeau, V. Méléder (2012)Microphytobenthos biomass mapping using the optical model of diatom biofilms:Application to hyperspectral images of Bourgneuf Bay. Remote Sensing ofEnvironment 127, 1-13
[9] Benyoucef I., 2014. Télédétection visibleproche-infrarouge de la distribution du microphytobenthos estuarien. Thèse deDoctorat de Nantes Université. 225 p.
Laboratoires partenaires
Laboratoire de Planétologie et Géodynamique Nantes - UMR CNRS 6112
Equipe d'Accueil Mer, Molécules, Santé - Nantes - EA 2160
Intervenants : Laurent Barillé, Ismail Benyoucef, Bruno Jesus, Patrick Launeau et Vona Méléder







